CHAPITRE 1 – L’organisation de la matière en cristaux.
Les cristaux sont des molécules présentes à l’état naturel dans les roches (ex : le quartz dans le granite), dans les êtres vivants (ex : coquille des escargots, squelette) et très utilisés en chimie, informatique, conception de matériaux … Ils appartiennent donc à la matière minérale, organique et synthétique.
Problème : Comment sont organisées les entités chimiques dans les cristaux ?
I- L’organisation cristalline
TP1 – L’organisation cristalline.
Les cristaux sont une organisation particulière de la matière, formés de l’assemblage ordonné et régulier d’atomes d’ions ou de molécules.
La structure microscopique d’un cristal est constituée d’une répétition dans l’espace de formes géométriques toutes identiques appelées mailles élémentaires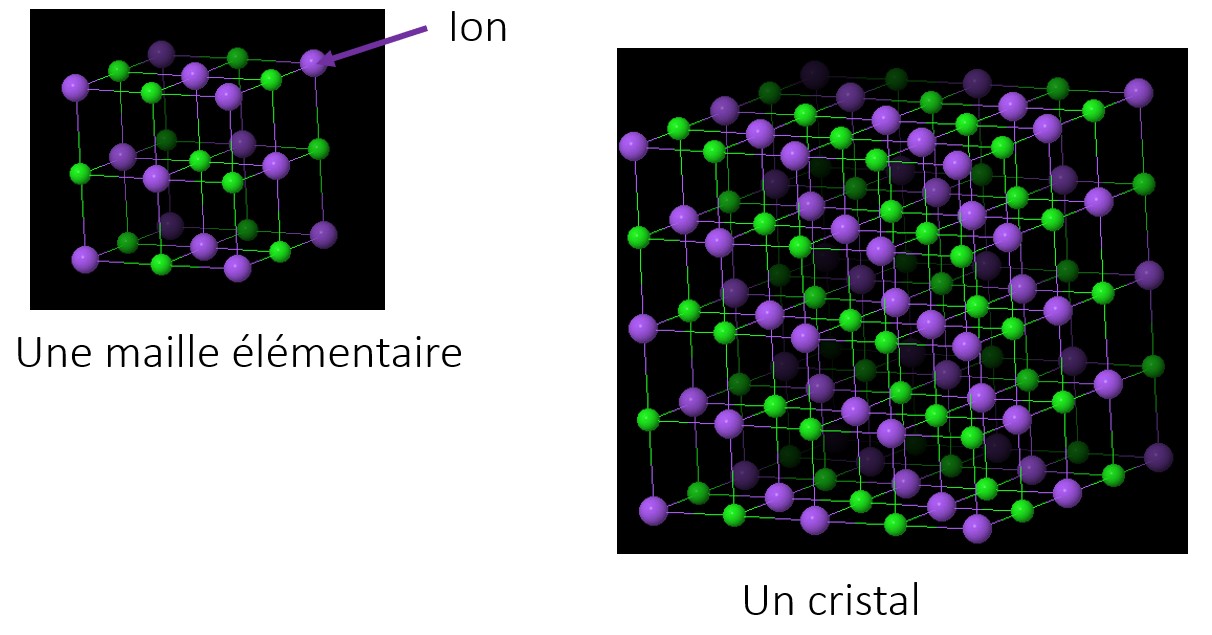
Un cristal est caractérisé par :
- la nature des entités chimiques qui le composent
- la forme de sa maille (cubique, hexagonale …)

- la disposition des entités chimiques dans la maille : c’est-à-dire le réseau cristallin (simple, faces centrées …)
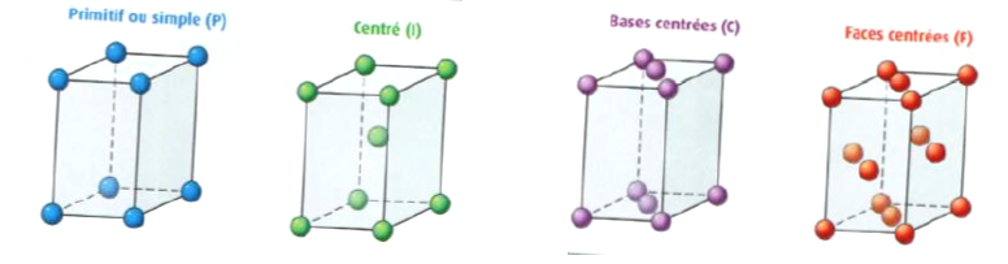
Pour chaque maille, on peut calculer sa multiplicité (nombre d’atome par maille), et sa compacité (volume occupé par les atomes dans la maille)
img20211004_20533753La multiplicité et la compacité de la maille vont définir sa masse volumique, sa dureté et de nombreuses autres propriétés du cristal.
Ainsi, ce sont les propriétés de la maille qui déterminent les propriétés du minéral
Par exemple, pour le cristal de chlorure de sodium, la maille est cubique à faces centrées et formée d’ions Na+ et Cl–. Le cristal de sel est donc de forme cubique.
Exercices d’entrainement et d’approfondissement
Un même composé chimique peut cristalliser sous différentes mailles, ce qui entrainera des propriétés différentes à l’échelle macroscopique : par exemple, le graphite et le diamant sont tous deux des cristaux de carbone, mais leur maille est différente
La compacité du diamant étant plus élevée (car sa maille est différente) , sa dureté est plus grande
La masse volumique du diamant étant plus élevée (car sa maille est différente), sa densité est plus grande
